Приложения сярна киселина - studopediya
Търговско клас сярна киселина
Сярна киселина
В техниката под сярна киселина разбират всякакви смеси от серен триоксид с вода, всъщност безводен сярна киселина H 2SO 4 наречен монохидрат, SO3 разтваря в 100% H 2SO 4 наречен олеум.
Физични свойства. Безводен сярна киселина (монохидрат) - безцветен, маслена течност с Тсг = 10.37 ° С Tc = 296,2 ° С # 961; = 1,85 гр / см 3 не пуши, не цвят и мирис, смесва се с вода и серен анхидрид във всички пропорции. При смесване е оформена поредица от съединения с различна температура на кристализация.
Modern промишленост произвежда няколко търговски степени на сярна киселина и олеум, характеризиращ се с концентрацията и чистотата:
Тези състави класове търговско сярна киселина идентифицирани като имащи най-ниската температура на кристализация. това се прави, за да се избегне кристализация на сярна киселина по време на транспортиране и съхранение.
Сред минералните киселини, произведени от химическата промишленост, сярна киселина по отношение на производството и потреблението на първо място. световното производство на сярна киселина в момента е 160 млн. тона годишно.
Концентрирана сярна киселина не разрушава цветни метали. В същото време, сярна киселина е един от най-силните минерални киселини.
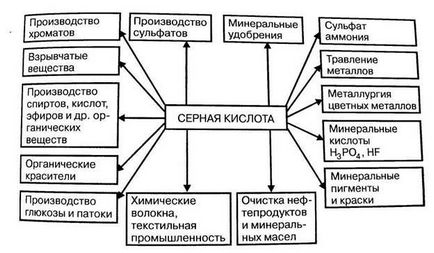
1) Сярна киселина е широко използван в производството на фосфатни торове. различни соли и киселини. При производството на минерални торове се консумира до 50% от произведения сярна киселина.
2) Голям брой (до 10%) сярна киселина се използва за пречистване на нефт и цветни метали.
3) В металообработването, сярна киселина се използва за отстраняване на ръжда от цветни метали повърхности преди покриването им с защитни лакове и цветни метали.
4) разредена сярна киселина и нейните соли се използват в производството на бои (до 15%), лакове; медикаменти, детергенти, експлозиви, в текстилната промишленост и производството на химични влакна.
5) Тъй като производството на катализатора в хидролизата
6) дехидратиращо средство в сушене на газове
Суровините за производство на сярна киселина.
Трябва да се подчертае, че по време на обработката на метали sulfidovtsvetnyh голямо количество серен оксид (IV) (10%), което може да се използва директно за производство на сярна киселина.
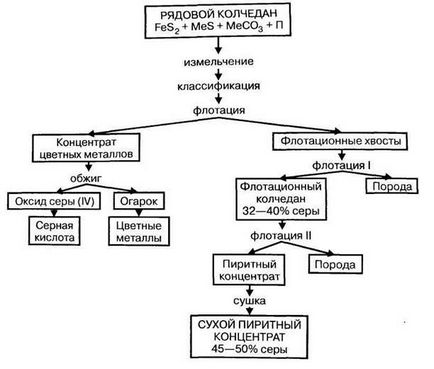
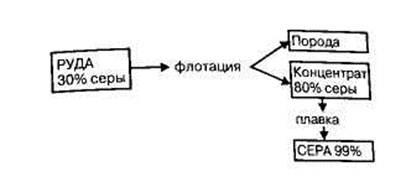
2) Свободен сяра (S) е най-модерната суровина за производство на сярна киселина. Сярата лесно изгаря във въздушния поток без образуване на отпадъци и странични продукти. Елементен сяра може да се получи от сяра руди или газове, съдържащи сероводород или серен оксид (IV). Съответно се прави разлика роден сяра и сяра газ (еднократно). Газообразен източник на сяра се газ кондензат депозити и депозити, свързани gaza.Iz роден сяра руди се претопи в пещи, автоклави или директно в подземни резервоари (метод Frasch). За тази стопена сяра директно под, прегрята вода изпомпване на кладенеца, и стопена сяра се екструдира върху повърхността сгъстен vozduhom.Na фигура показва схема на получаване на нативния сяра.
3) сероводород. По време на обработката на нефтен продукт сероводород оформен. сероводород, и служи като източник на други горими газове: кокс, генератор, преминаване. Сероводород капан, концентрира се и след това се изгарят за получаване на серен оксид (IV), след това се обработва до сярна киселина.
3.3. ПРОИЗВОДСТВО НА сярна киселина производството на сярна киселина от съдържащи сяра суровина включва няколко химични процеси: 1. Първият етап на всяко растение сярна киселина за получаване на серен диоксид SO2 от сяра суровина. 2. Допълнителна серен диоксид внимателно се почиства (по-специално в случая на метод контакт), се окислява до серен триоксид. 3. абсорбция на серен триоксид с вода до образуване на сярна SO2 да SO3 kisloty.Okislenie при нормални условия е бавен. Катализатори, използвани за ускоряване на този етап от процеса.
При метода за контакт за получаване на сярна киселина SO2 окисляване на SO3 се провежда върху твърда контакт маса. Когато азотни метод катализатори са азотни оксиди, окислението се провежда в течна фаза в опакованите кули, така наречения метод кула азотен. Атмосферните отработените газове замърсяване (SO2, SO3 NO2 ..) на производство кула и лошо качество на киселина - основна причина изместване азотен метод.
SO2 + NO2 + Н 2О = H 2SO 4 + NO; 2NO + O2 = 2NO2. В действителното производство на тези химични процеси се добавят към процесите за получаване на суровини, в пещ газ и почистване някои други производствени операции. Като цяло, схема производство на сярна киселина може да бъде изразена както следва: Суровини ®podgotovka ® ® калциниране пещ пречистване суров газ ®
Връзка ® ® ® контакт газова абсорбция сярна kislotaKonkretnaya технологична схема производство зависи от вида на суровината, характеристиките на каталитично окисление на SO2. присъствие или отсъствие на стъпка абсорбция SO3 серен оксид.