Структурата на полипептидната верига и пептидната връзка
аминокиселинни мономери, които са част от полипептиди, аминокиселинни остатъци, посочени. Аминокиселинен остатък със свободна амино група, наречен N-терминал и се записва в ляво на пептидната верига, и имащ свободна α-карбо-ksilnuyu група - С-края, и се записва в дясно. Обхватът на тази схема се повтаря атома-CH - СО - NH- в polipetidnoy веригата наречен пептиден скелет.
верига полипептид има следната обща форма:
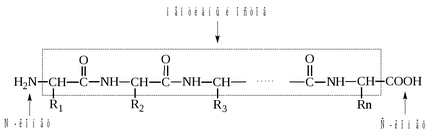
където R1. R2. R3. ... Rn - аминокиселинни остатъци, които страничната верига.
В проява на биологичните функции на пептиди и протеини играе важна роля на електронните и пространствената структура на пептид групата:
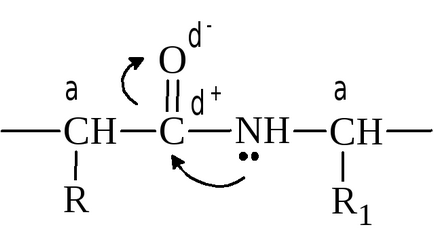
Наличието на р-π-конюгиране група в пептида води до частична dvoesvyazannosti връзка - Н. дължина пептидна връзка на С - М е равно на 0.132 пМ и дължина връзка N - Sα е 0.147 пМ. Единична връзка С - N, в пептидите от около 40% има характера на двойната връзка и двойна връзка С = О при около 40% е единствен. Този факт има две важни последици:
1) имино група (- NH -) пептидна връзка е не подчертано изразена способност да разцепи или свързване на протон;
2) свободно въртене около връзка C - N линия.
Частично dvoesvyazannost С - N означава, че пептидната част е плоска част на пептидната верига. Пептид групи равнина, разположена под ъгъл един към друг:
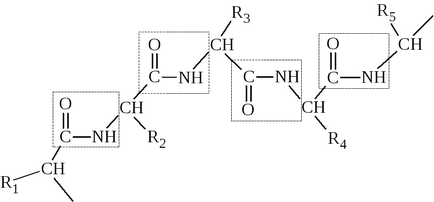
Около C - Sα и на N - Sα възможно въртене, макар и ограничена по размер и естеството на радикалите, позволявайки полипептидните вериги да предприемат различни конфигурации.
Връзката на пептид е единична ковалентна връзка, с помощта на които аминокиселинните остатъци са свързани един с друг, образуващи скелета на протеиновата молекула.
облигации пептид обикновено се намира в транс конфигурация, т.е. α-въглеродни атоми са разположени от двете страни на пептидната връзка. В резултат, странични групи на аминокиселини са в пространството на далечното разстояние един от друг.
Homenklatura пептиди
Когато заглавието на полипептид на името на всички аминокиселинни остатъци с изключение на последния, добавете наставка ил. крайна аминокиселина завършва с -в. Например, пептидът Met-Asp-Val-Pro е пълното име на метионил аспартил излива пролин.
Алкално-киселинното свойства на пептидите
Много къси пептиди се получават в чиста кристална форма кристал. Високата температура на точката на топене на тази на неутрални разтвори пептиди кристализира като биполярни йони. Тъй като нито един от а-карбоксилни групи, и нито един от а-амино групи са включени в образуването на пептидни връзки, не може да се йонизира в обхвата на рН 0-14, на киселинно-основни свойства на пептиди се определят от свободен NH2 групата на N-терминалния остатък и свободна карбоксилна група с-терминалния остатък на пептида и тези R групи, които са способни на йонизация. Броят на дълги пептидни вериги йонизирани R-групи са обикновено големи в сравнение с двете крайни групи йонизирани пептидни остатъци. Следователно, за да се характеризират киселина базови свойства на пептиди, ще разгледа къси пептиди.
Свободната α-амино и свободен терминална карбоксилна група в пептидите разделени от разстояние значително по-голяма от прости аминокиселини, и следователно, електростатично между действие между тях отслабена. РК стойности на крайните карбоксилни групи в пептидите е малко по-високи и на терминал α-амино групата е малко по-ниски, отколкото в съответните свободни аминокиселини. В R групи не се различават значително в къси пептиди и свободни аминокиселини в съответните стойности рК.
За да се определят границите на рН, в който изоелектричната точка може да бъде къс пептид теста, достатъчно е да се сравни броя на свободните аминогрупи и броя на свободни карбоксилни групи, включително N- и С-крайни групи. Ако броят на аминогрупи надвишава броя на карбоксилни групи izoelektri Env пептид точка ще лежи в рН област алкална, за да се предотврати протонирането на амино групи, необходими алкален. Ако броят на карбокси групи надвишава броя на амино групи, изоелектричната точка ще бъде в кисела рН диапазон, тъй като киселата среда инхибира разпадането на карбоксилни групи.