Закони електроотрицателност промени и елементи в дадена група, показани
В този урок ще научите за законите се променят електроотрицателност елементи в групи и периоди. На него ще се разгледа, от които зависи електроотрицателност на химичните елементи. В примера елементи на втория период на проучване на структурата на промяна в Електроотрицателност елемент.
Тема: Химична връзка. електролитна дисоциация
Уроци: Модели на промени в Електроотрицателност на химическите елементи в групата и периода
1. Закони променя електроотрицателност стойности, показани в
Закономерности на промени в относителни стойности електроотрицателност в периода
Да разгледаме например елементи на втория период, промени на моделите в ценностите на тяхната относителна електроотрицателност. Фиг.1.
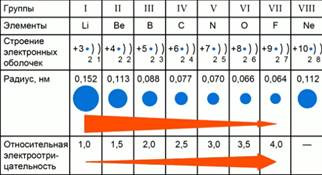
Фиг. 1. Закони променя електроотрицателност стойности на елементи на период 2
Относителна химичен елемент електроотрицателност зависи от ядрен заряд и радиуса на атома. През втория период са елементите: Li, Be, В, С, N, О, F, Ne. От литиево флуорид към ядрения заряд се увеличава и броят на външните електрони. Броят на електронни слоеве остава непроменена. Следователно, притегателната сила на външните електрони към сърцевината ще се увеличи, и като атомът ще бъдат компресирани. Радиусът на атома на литиев флуорид ще намалее. По-малкият атомен радиус, толкова външните електрони са привлечени към ядрото, и следователно относително голяма електроотрицателност.
Периодът с повишени ядрен заряд атомен радиус намалява и относителните електроотрицателност увеличава.
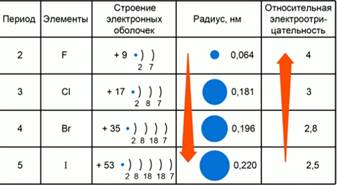
Фиг. 2. закони електроотрицателност стойности на елементи променят групи VII-A.
2. Модели на промени в електроотрицателност стойности в групата
Закономерности на промени в относителни стойности електроотрицателност в големите подгрупи
Помислете за един модел на относителни промени електроотрицателност в големи подгрупи например раздел VII-A групи. Фиг.2. В седмия групата, основните подгрупи разположени халоген: F, CI, Br, I, В. На външен електронен слой в тези елементи е същия брой електрони - 7. С увеличаване атомен заряд ядро по време на прехода от един период към друг, броят на електрони слоеве и следователно увеличава атомен радиус. По-малкият атомен радиус, по-голяма от стойността на Електроотрицателност.
Основната подгрупата с увеличаване на атомно ядро зареждане атомен радиус се увеличава и намалява относителната електроотрицателност.
Тъй като елемент флуор химически се намира в горния десен ъгъл на система Г. Периодичната I.Mendeleeva неговата относителна стойност Електроотрицателност е максимална и равна на 4.
Заключение: относителни електроотрицателност увеличава с намаляване радиус на атома.
В периоди с увеличаване на атомното ядро зареждане електроотрицателност се увеличава.
Основните подгрупите с увеличаване на атомното ядро събират относителна Електроотрицателност химичен елемент намалява. Най-електроотрицателен химичен елемент - е флуор, тъй като се намира в горния десен ъгъл на периодичната Г. I.Mendeleeva.
Обобщавайки резултатите от урока
В този урок, което сте научили за законите се променят електроотрицателност елементи в групи и периоди. На него можете разгледа това, което определя електроотрицателност на химичните елементи. В примера елементи на втория период модели промени проучен Електроотрицателност елемент.
Списъкът на препоръчителна четене
Препоръчителни връзки към онлайн ресурси
Препоръчителна домашна работа
2 предоставя примери на неполярни вещества с ковалентна и йонна връзка. Какво прави електроотрицателност във формирането на тези съединения?
3. Поставете в поредица от възходящ електроотрицателност елементи от втората група от основната група.
Зарежда.
Вие трябва да изтеглите учебните планове на тема "Модели на промяна в електроотрицателност на елементите в групи и периоди. Hold връзка
Зарежда.
Известни произведения
- Пейзажи в текста на S.Pushkina
- Анализ Blok стихотворение "В областта Kulikovom"
- Баща и син в историята Г. Олдридж "The Last Inch"
- Живота и творчеството на Гьоте VI
- Решенията на арбитражния съд. задачи
- Проектиране кетъринг дизайн закусвалня. част 2
- А. и S. S.Pushkin A.Esenin на руски характер
-
Статистика проекта