Silanes - химическа енциклопедия
Съобщение характеристика на силани, тяхната изключително лесно окисление. За Port. с n3 р-ще се получи със силна експлозия. Monosilane в присъствие. O2 се окислява със светкавица, дори когато T'-D течен въздух. В зависимост от условията на р-ТА продукт на окисление е или SiO2. или межд. на островите. Силани, добър редуктор. те преведе KMnO4 да MnO2. Hg (II), за да Hg (I), Fe (III) до Fe (II), и т.н. И сътр. комуникация характеристика на лекота на хидролиза-силани. особено в алкална среда, напр.:
P-TION е количествен и може да се използва за определяне на силани под действието на алкален също е възможно комуникация разцепване Si - Si, напр.:
С кислород Conn. напр. с ацетон. сексуално-диетилов етер, силани взаимодействат в газова фаза при висока m-D за образуване алкоксисилани ROSiH3. С alifatich. алкохоли в присъствие. OH - йони (катализатор) силани образуват тетраестери.
Вземете най-силан. начина: 1) от разлагането на метал силициди-трет или основи. Често използвани Mg2 Si, до позиция се разлага в солна-он в инертна атмосфера. схема Възможна р-ТА:
Произведени силани са разделени чрез кондензиране стъпка. и след това отделяне на фракция диспергира при ниска T-D.
2) Редукция на Li халид Si хидрид или LiAlH4. В етанол среда при нормална т-D са, например. марка. р-ТА:
С LiAlH4 образува чисти силани с висок добив.
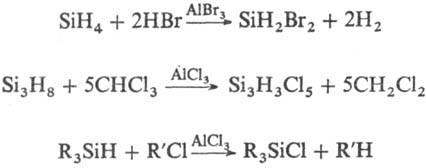
3) Възстановяване Si водородни халиди. Процесът се провежда в присъствието. А1 халогениди или Al или Zn добавя като компонентите на р-ционни. SiH4 също получен чрез разлагане (С2 Н5 О) 3 SiH при 20-80 ° С в присъствието. На. Monosilane-започвайки от получаване на полупроводникови силиций.