свойства азотна киселина, получаване и използване

Азотна киселина (HNO3 формула) е силен едноосновен киселина. Не-окислено състояние, изглежда като на снимката 1. При нормални условия, е течен, но това може да се превърне в твърдо състояние на агрегиране. И там го напомня кристали с моноклинна или ромбовидна решетка.
Химичните свойства на азотна киселина

За синтетичен амоняк азотна киселина се окислява с помощта на катализатор платина родий преди сместа от азотни газове, които са впоследствие абсорбира вода. също така се образува при смесване и нагряване железен нитрат и калиев сулфат.

С производство на торове киселина азотна, експлозиви и някои отрови. Това е гравирани плочи (ецване борда подложка магнезий и т.н.), и дори тонизиращо подкислява решения за снимката. От произвеждат багрила азотна киселина и лекарства, и с негова помощ се определи наличието на злато в златни сплави.
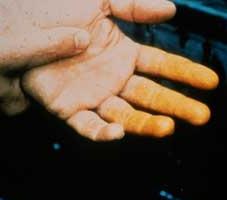
Като се има предвид степента на влияние на азотна киселина върху тялото, тя е класифицирана в трети клас на опасност (умерено опасно). Вдишването на неговата пара причинява дразнене на дихателните пътища. След контакт с кожата азотна киселина оставя много дълго време да се лекува язви. на кожата, където тя е била да се превърне в характерен жълт цвят (виж снимката). Научно погледнато, има ksantoproteinovaya реакция. Азотен диоксид, който е получен чрез нагряване с азотна киселина или нейното разлагане в светлината, е силно токсичен и може да предизвика белодробен оток.
Азотна киселина е от полза за човек да се разрежда и чист. Но по-често се среща в състава на вещества, много от които могат да бъдат сте запознат с (като нитроглицерин).